1. Đại cương
1.1. Khái niệm
Hội chứng não -gan, là tình trạng rối loạn rối loạn ý thức, hành vi và hôn mê do rối loạn chức năng gan gây ra. Sinh bệnh học là rối loạn trao đổi chất của hệ thống thần kinh trung ương do các độc tố không được gan chuyển hóa và đào thải vì suy chức năng gan.
Hội chứng não -gan thường xảy ra do shunt cửa-chủ (Portosystemic shunt) là tình trạng nối thông giữa tĩnh mạch cửa và tĩnh mạch chủ của tuần hoàn bàng hệ hoặc do phẫu thuật tạo shunt cửa – chủ để làm giảm áp lực tĩnh mạch cửa. Do đó, một lưu lượng lớn máu từ hệ tiêu hóa vào thẳng hệ tuần hoàn bỏ qua gan là cơ chế chủ yếu của bệnh não.Hội chứngnão -gan tiềm tàng là chỉ có bất thường về sinh hóa mà không có biểu hiện lâm sàng rõ ràng, việc chẩn đoán hội chứng não -gan trong giai đoạn này cần mộttest kiểm tra trí thông minh và (hoặc) thử nghiệm điện sinh lý có rối loạn.
Hình 1: Sơ đồ mô tả shunt cửa-chủ (Portosystemic shunt).
Rối loạn chức năng não do suy gan (hội chứngnão – gan) tiến triển dần dần do các chất độc tích tụ, do đó hội chứng não – gan được phân loại thành bốn giai đoạn. Giai đoạn 1 và 2 đại diện cho mức độ nhẹ đến trung bình, chức năng của não bị ức chế. Giai đoạn 3, trầm cảm nặng, nghĩa là não đã bị tổn thương. Giai đoạn cuối củahội chứngnão gan là giai đoạn 4. Ở giai đoạn này, toàn bộ não bị ảnh hưởng và bệnh nhân trở nên bất tỉnh và không đáp ứng với kích thích đau đớn (hôn mê gan).
1.2. Nguyên nhân của hội chứng
Hầu hết các bệnh nhân bị hội chứng não – gan là do xơ gan (xơ gan là bệnh phổ biến nhất) và phẫu thuật nối thông tĩnh mạch cửa và tĩnh mạch chủ để giải quyết tình trạng tăng áp lực tĩnh mạch cửa (phẫu thuật tạo shunt portosystemic). Nếu tính cả hội chứng não – gan giai đoạn tiềm tàng (giaiđoạn 0)thì tỉ lệ hội chứng não – gan lên đến 70% các bệnh nhân bị bệnh gan. Một tỉ nhỏ của hội chứng não – gan thấy trong viêm gan siêu vi nặng, nhiễm độc gan và bệnh gan do thuốc giai đoạn suy gan cấp tính hoặc tối cấp. Nguyên nhân hiếm hơn là ung thư gan nguyên phát, gan nhiễm mỡ cấp tính của thai kỳ, nhiễm trùng đường mật nghiêm trọng.
Hội chứng não – gan thường xảy ra sau thủ thuật nối thông cửa – chủ, sau chảy máu đường tiêu hóa trên, sử dụng nhiều thuốc lợi tiểu, cổ trướng nặng, chế độ ăn uống giàu protein, thuốc an thần, thuốc mê, táo bón, nhiễm độc niệu, phẫu thuật và nhiễm trùng. Các yếu tố trên được coi là yếu tố nguy cơ gây hội chứng não – gan ở các bệnh nhân bị bệnh gan.
1.3. Sinh bệnh học
Sinh bệnh học của hội chứng não – gan đến nay chưa được hiểu đầy đủ. Người ta cho rằng cơ sở sinh lý bệnh của hội chứng não – gan là do suy tế bào gan và luồng thông cửa – chủ do phẫu thuật hay do sự hình thành tự nhiên của tuần hoàn bàng hệ. Nhiều chất độc hại từ máu của hệ tiêu hóa không được gan chuyển hóa và loại bỏ đã vào hệ tuần hoàn và thấm qua hàng rào máu-não đến não, gây rối loạn chức năng não. Hội chứng não gan là kết quả của nhiều yếu tố, như các chất đạm bao gồm protein, axit amin, amoniac, mercaptan, rối loạn chuyển hóa, và sự tích tụ của các chất dẫn truyền thần kinh ức chế do không được gan chuyển hóa có thể đóng một vai trò quan trọng. Rối loạn đường máu, rối loạn nước và điện giải và giảm oxy có thể góp phần vào quá trình chuyển hóa năng lượng của não và làm tăng hội chứng não – gan. Chuyển hóa chất béo, đặc biệt là sự gia tăng axit béo chuỗi ngắn cũng đóng một vai trò quan trọng. Ngoài ra, bộ não của bệnh nhân bị bệnh gan mạn tính tăng độ nhạy cảm với độc tố cũng là một yếu tố quan trọng. Về cơ chế bệnh sinh của hội chứng não – gan có rất nhiều giả thuyết, trong đó được nghiên cứu nhiều nhất và có bằng chứng chắc chắn nhất là lý thuyết ngộ độc amoniac.
1.3.1. Thuyết ngộ độc amoniac
Rối loạn chuyển hóa amoniac gây ra ngộ độc amoniac là bệnh sinh chính của hội chứng não – gan, đặc biệt là khi có shunt nối thông cửa – chủ. Shunt nối thông cửa – chủ là nguyên nhân quan trọng của bệnh não liên quan đến ngộ độc amoniac, còn được gọi là bệnh não do nitrogen (nitrogen encephalopathy).
– Sự hình thành và chuyển hóa của amoniac
Amoniacđược tạo rachủ yếu từ ruột, thận và cơ vân, nhưng đường tiêu hóa là cửa ngõ chính vào cơ thể của amoniac. Bình thương hàng ngày hệ tiêu hóa sản sinh ra 4g amoniac, lượng amoniac này chủ yếu do các vi khuẩn đường ruột có men urease phân hủy nitơ thành urê tạo ra và được hấp thu từ đường ruột vào máu, chỉ một phần nhỏ protein trong thực phẩm được vi khuẩn đường ruột chuyển hóa thành acid amin. Hấp thu amoniac trong ruột chủ yếu là amoniac không ion (NH3), chúng được khuếch tán vào niêm mạc ruột. NH3 khuếch tán dễ dàng vào máu và có tính độc hại, chúng có thể qua được hàng rào máu não. NH4 là dạng muối, tương đối không độc và không qua được hàng rào máu-não. Amoniac được tế bào biểu mô ống thận bài tiết dưới dạng NH4 làm nước tiểu acid. Khi cơ thể nhiễm kiềm, một lượng lớn NH3được hấp thu vào tĩnh mạch thận để vào máu, làm amoniac máu tăng. Khi cơ thể nhiễm axit, amoniac đổ vào trong lòng ống thận dưới dạng muối amoni (ví dụ như NH4Cl) để bài tiết qua nước tiểu, Đây là một cơ chế quan trọng bài tiết axit của thận. Ngoài ra, khi hoạt động thể lực các cơvân và cơ tim cũng giải phóng amoniac làm chúng tăng lên trong máu.
– Các hình thức thải trừ amoniac của cơ thể:
+ Amoniac được gan chuyển hóa thành ure, đây là con đường chuyển hóa chính. Sau quá trình trao đổi chất, amoniac trong vòng ornithine được chuyển thành urê.
+ Não, gan, thận và các mô: chuyển hóa amoniac thành glutamate và glutamine (α-ketoglutarate kết hợp với NH3 → glutamic acid, glutamic kết hợp với NH3 → glutamine).
+ Bài tiết amoniac dưới dạng ure của thận là cơ chế chính để đào thải amoniac ra khỏi cơ thể, ngoài thải ra một lượng lớn urê, thận cũng loại trừ một số lượng lớn amoniac dưới dạng bài tiết NH4.
+ Khi nồng độ amoniac trong máu quá cao, một lượng nhỏ có thể được phổi đào thải qua hơi thở.
– Suy chức năng gan là nguyên nhân chính gây bệnh não của amoniac khi amoniac trong máu cao. Tăng cao amoniac quá mức trong máu cũng có thể do nguyên nhân ngoại sinh hay nội sinh. Ngoại sinh như uống quá nhiều thực phẩm đạm thủy phân hoặc sử dụng ma túy. Tăng amoniac máu nội sinh có thể do quá trình tạo amoniac quá mức của vi khuẩn đường ruột, chẳng hạn như bệnh nhân suy thận hoặc có hội chứng thận hư lại ăn quá nhiều đạm, ure trong máu cao được bài xuất qua niêm mạc ruột già rồi được chuyển thành amoniac, sau đó amoniac lại khuyếch tán vào niêm mạc ruột rồi vào máu. Xuất huyết tiêu hóa, máu trong đường ruột bị phân hủy thành amoniac rồi được hấp thu vào máu. Quá trình sản xuất amoniac từ lượng đạm trong thức ăn cũng tương tự. Trong suy chức năng gan, gan giảm hoặc mất khả năng chuyển amoniac thành ure. Khi có shunt cửa – chủ amoniac trong tĩnh mạch cửa đổ thẳng vào tĩnh mạch chủ mà không qua gan do đó không được gan chuyển hóa làm tăng amoniac máu.
– Một số yếu tố ảnh hưởng đến ngộ độc amoniac gây ra bệnh não – gan: có nhiều yếu tố có thể ảnh hưởng đến lượng amoniac vào mô não, và (hoặc) thay đổi sự nhạy cảm của mô não với amoniac.
+ Hạ kali máu nhiễm kiềm: ăn ít, nôn mửa, tiêu chảy, dùng nhiều thuốc lợi tiểu bài tiết kali, cổ trướng, giảm chuyển hóa aldosteron thứ cấp so suy chức năng gancó thể dẫn đến hạ kali máu. Hạ kali máu trong nhiễm kiềm do thay đổi sự phân bố trong và ngoài tế bào của kali (kali từ ngoại bào vào nội bào làm giảm kali máu). Giảm kali do mất dịch ngoại bào làm kali từ ngoại bào di chuyển vào nội bào. Hơn nữa, bài tiết kali và hydro tăng qua thận do tăng tái hấp thu natri của ống lượn xa và ống góp khi mất nước ngoại bào làm giảm kali máu, bài tiết kali và ion hydro tăng lên, dẫn đến nhiễm kiềm chuyển hóa làm tăng thấm NH3 qua hàng rào máu – não để xâm nhập vào các tế bào não gây độc. Bệnh não do shunt cửa – chủ nhất làở những bệnh nhân có amoniac trong máu cao sẽ giảm sau khi amoniac máu được điều chỉnh trở về bình thường, biểu hiện ý thức bệnh nhân tốt lên hoặctrở về bình thường. Nhiều trường hợp suy gan tối cấp, mặc dù amoniac đã được điều chỉnh về bình thường nhưng bệnh nhân vẫn trong tình trạng hôn mê sâu. Ngoài ra ở những bệnh nhân bị xơ gan, do sử dụng thuốc an thần, thuốc ngủ hoặc thuốc gây mê, bệnh não cũng xảy ra mặc dù nồng độ amoniac máu có thể bình thường hoặc cao hơn một chút, đây là những bệnh não không nitơ, chiếm tỉ lệ 1/3 tất cả các bệnh não – gan.
+ Ăn hoặc uống quá nhiều thực phẩm có chứa nitơ hoặc các loại thuốc, hoặc chảy máu đường tiêu hóa trên (mỗi 100ml máu chứa khoảng 20g protein), các yếu tố trên làm sản xuất amoniac trong đường ruột tăng lên.
+ Oxy trong máu thấp: gặp trong chảy máu đường tiêu hóa trên, chọc hút khối lượng lớn dịch cổ trướng, dùng nhiều thuốc lợi tiểu. Sốc và giảm oxy máu có thể gây ra suy thận cấp trước thận làm tăng amoniac trong máu. Các tế bào não có thể bị giảm khả năng chịu thiếu oxy và đễ độc amoniac.
+ Táo bón: làm cho amoniac, amin và các dẫn xuất độc hại khác tăng trong đường ruột và tiếp xúc lâu dài với niêm mạc đại tràng làm tăng sự hấp thụ chất độc.
+ Nhiễm trùng: tăng dị hóa mô làm tăng sản xuất amoniac, mất nước có thể làm trầm trọng thêm do suy thận cấp trước thận, thiếu oxy và tăng thân nhiệt dễ làm tăng độc tính của amoniac với tế bào não.
+ Hạ đường huyết: Glucose là nguồn cung cấp năng lượng quan trọng của não bộ, hạ đường huyết làm não dễ bị nhiễm độc bởi amoniac, làm độc tính của amoniac tăng lên.
+ Các yếu tố khác: thuốc an thần, các chất trực tiếp ức chế trung tâm hô hấp, thiếu oxy máu, gây mê và phẫu thuật làm tăng hội chứng não – gan.
– Ngộ độc amoniac trên hệ thống thần kinh trung ương: các tế bào não rất nhạy cảm với amoniac. Xơ gan làm tăng lượng amoniac trong máu, shunt cửa – chủ làm tăng amoniac máu. Amoniac máu tăng thấm qua hàng rào máu não làm tăng nồng độ amoniac trong mô não. Amoniac có tác dụng độc hại với tế bào não, làm chuyển hóa năng lượng trong tế bào não bị rối loạn. Amoniac có thể ức chế hoạt động của enzym pyruvate dehydrogenase gây ảnh hưởng đến sự hình thành acetyl-coenzyme A. Mặt khác, quá trình não chuyển hóa amoniac bằng con đường kết hợp amoniac với α-ketoglutaric axit và axit glutamic để tạo thành glutamine, những phản ứng này cần tiêu thụ một số lượng lớn các coenzyme, ATP, α- ketoglutaric axit và axit glutamic. Axit glutaric α-keto là một sản phẩm trung gian quan trọng trong chu trình Krebs để tạo năng lượng, thiếu chất này làmcác tế bào não thiếu nguồn cung cấp năng lượng, không thể duy trì chức năng bình thường. Glutamate tham gia dẫn truyền thần kinh của não, thiếu nó làm gia tăng ức chế não.
– Amoniac, mercaptan, và axit béo chuỗi ngắn có tác dụng hợp đồng độc tính.
Methyl mercaptan được tạo thành do chuyển hóa của methionine trong đường tiêu hóa bởi vi khuẩn, methyl mercaptan và dimethyl sulfoxide gây ra ở động vật thí nghiệm các triệu chứng nhầm lẫn, mất định hướng, bán hôn mê và hôn mê. Tăng nồng độ methionine trong máu ở bệnh nhân xơ gan xảy ra sau khi ăn có thể là cơ chế của bệnh não – gan với hai loại chất chuyển hóa có liên quan. Mùi gan trong hơi thở của bệnh nhâncó thể là methyl, và dimethyl disulfide dễ bay hơi cùng với mùi mercaptan. Ở những bệnh nhân bị bệnh gan nặng, tăng nồng độ methyl mercaptan trong máu thấy bệnh não tăng lên rõ rệt. Axit béo chuỗi ngắn (chủ yếu là hexanoic acid và acid octanoic) là sản phẩm phân hủy của một axit béo chuỗi dài bởi vi khuẩn có thể gây ra bệnh não – gan trong thực nghiệm. Những bệnh nhân bị hội chứng não – gan cũng thấy các acid béo chuỗi ngắn này trong huyết tương và dịch não tủy tăng lên đáng kể.
Suy gan ở động vật thí nghiệm, khi sử dụngđơnđộcamoniac, mercaptan hay acid béo chuỗi ngắn với lượng thấp không đủ để gây rahội chứngnão -gan, nhưng nếu sử dụng kết hợp, ngay cả khi cùng một liều lượng thấp như trên cũng có thể gây ra các triệu chứng não, do đó một số tác giả đã đề xuất amoniac, mercaptan, acid béo chuỗi ngắn có tác dụng hiệp đồng độc tính trên hệ thống thần kinh trung ương. Tác dụng độc hại hiệp đồng này có thể có vai trò quan trọng trong cơ chế bệnh sinh của hội chứng não – gan.
1.3.2. Thuyết dẫn truyền thần kinh giả
Dây thần kinh dẫn truyền xung động thông qua chất dẫn truyền thần kinh. Dẫn truyền thần kinh có hai loại là kích thích và ức chế, cả hai để duy trì cân bằng sinh lý bình thường. Dopamine là chất dẫn truyền thần kinh kích thích, trong khi catecholamine và norepinephrine, acetylcholine, glutamate và aspartate vv, là chất dẫn truyền thần kinhức chếtrong não.
Các thực phẩm có axit amin thơm như tyrosin, axit acrylic vv, được các vi khuẩn đường ruột có emzym decarboxylase chuyển thành tyramine và phenylethylamine. Cả hai amin trên, bình thường được enzym monoamine oxidase ở gan phân hủy. Khi suy gan, hai amin này tồn tại trong tuần hoàn và thấm qua hàng rào máu não để vào mô não. Trong não, thông qua vai trò của β-hydroxylase, các amin tương ứng được hình thành là tyramine β-hydroxybutyrate và phenylethanolamine. Cấu trúc hóa học của các amin này gần giống norepinephrine, chúng cạnh tranh với norepinephrine nhưng không có tác dụng dẫn truyền các xung thần kinh, hoặc có tác dụng rất yếu, vì vậy được gọi là chất dẫn truyền thần kinh giả. Khi chất dẫn truyền thần kinh giả được các tế bào não hấp thu và thay thế chất dẫn truyền thần kinh bình thường trong các khớp thần kinh thì rối loạn dẫn truyền thần kinh xảy ra và gây ra sự ức chế vỏ não bất thường, rối loạn ý thức và hôn mê.
Cho đến nay, lý thuyết chất dẫn truyền thần kinh giả vẫn chưa được xác nhận đầy đủ.
1.3.3. Thuyết phức hợp thụ thể GABA/BZ
Axit γ-aminobutyric (GABA) là chất chủ yếu dẫn truyền thần kinh ức chế vỏ não ở động vật có vú. Các chất này cũng được các vi khuẩn đường ruột sản xuất và được hấp thu vào máu, khi tới gan được gan chuyển hóa. Khi có shunt cửa – chủ và suy gan, chúng có thể vượt qua gan vào hệ tuần hoàn. Trong những năm gần đây, trong suy gan tối cấp và trong thực nghiệm gây suy gan ở động vật cóhội chứngnão – gan thấy nồng độ chất GABA trong máu tăng. Chất GABA thấm qua hàng rào máu não để vào não. Người ta thấy nồng độ chất GABA ở thụ thể GABA sau khớp thần kinh tăng lên đáng kể. Thụ thể này không chỉ ràng buộc với GABA mà trong các phần khác nhau của bề mặt thụ thể cũng nhạy cảm với thuốc an thần và thuốc chống loạn thần yếu (benzodiazepine, BZs) nên nó được gọi là phức hợp thụ thể GABA/BZ. Cả hai loại thuốc này khi gắn vào thụ thể GABA, có thể thúc đẩy các ion clorua di chuyển vào các neuron sau synap và gây ức chế dẫn truyền thần kinh. Ở bệnh nhân có hội chứng não – gan, trong huyết tương thấy tăng nồng độ GABA tương ứng với mức độ nặng của hội chứng. Một vài bệnh nhân được sử dụng thuốc đối kháng thụ thể GABA, hoặc sử dụng liều thấp thuốc đối kháng thụ thể thuốc an thần trong điều trị thấy các triệu chứng não – gan giảm bớt, điều này được coi là bằng chứng của hội chứng – não gan do tăng chất dẫn truyền thần kinh ức chế (GABA).
1.3.4. Thuyết về sự mất cân bằng chuyển hóa amino acid
Người ta thấy nồng độ các amino acid thơm trong huyết tương của bệnh nhân xơ gan mất bù như phenylalanine, tyrosine, tryptophan tăng, trong khi các axit amin chuỗi nhánh như valine, leucine, isoleucine giảm. Hiện tượng trên phản ánh quá trình chuyển hóa hai loại axit amin trên bị mất cân bằng. Bình thường acid amin thơm được chuyển hóa trong gan, suy gan làm giảm phân hủy các acid này, do đó nồng độ trong máu của chúng tăng lên. Bình thường, axit amin chuỗi nhánh được tổng hợp chủ yếu trong quá trình chuyển hóa ở gan và ở cơvân mà không bị phân hủy. Suy gan làm giảm nồng độ các acid amin này trong máu đồng thời một số lượng lớn các axit amin chuỗi nhánh vào các mô cơ, do đó nồng độ trong máu giảm. Các rối loạn trên làm tỉ lệ tính theo mol của axit amin phân nhánh và axit amin thơm giảm thấp (bình thường tỉ lệ này là 3-3,5/1). Hai loại axit amin này cạnh tranh với nhau và loại trừ nhau để xâm nhập vào não thông qua hàng rào máu não và trao đổi glutamine. Axit amin chuỗi nhánh giảm và gia tăng các axit amin thơm vào não, hơn nữa sự hình thành của các chất dẫn truyền thần kinh giả như đã mô tả trên đây đã gây ra rối loạn và ức chế dẫn truyền thần kinh trong não. Ở bệnh nhân xơ gan, do chuyển hóa trong gan giảm, làm giảm nồng độ albumin huyết tương, gây ra sự gia tăng trong huyết thanh tryptophan. Tryptophan có thể làm gia tăng trong não chất 5 – serotonin, một chất dẫn truyền thần kinh ức chế trong tổ chức thần kinh trung ương do đó hôn mê cũng có thể có liên quan. Arginine, axit glutamic và acid aspartic bản thân chúng hoặc các dẫn xuất của chúng có tác dụng đối kháng với ngộ độc amoniac trong thực nghiệm cho thấy có tác dụng đảo ngược triệu chứng của hội chứng não – gan. Điều này cũng thấy ở bệnh nhân hôn mê gan do xơ gan.
1.3.5. Nhiễm độc mangan
Chụp cộng hưởng từ sọ não ở bệnh nhân xơ gan thấy trên hình ảnh T1W trong globus pallidus các tín hiệu tăng do lắng đọng mangan. Mangan thường được gan bài tiết vào túi mật rồi đến đường ruột và sau đó theo phân ra ngoài. Bệnh gan có thể làm mangan không được bài tiết như bình thường mà được đưa vào máu, tích tụ trong não gây độc hại cho não.
1.4. Mô bệnh học não trong hội chứng não – gan
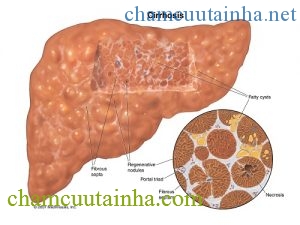
Suy gan cấp tính gây hội chứng não – gan thường không thấy bất thường giải phẫu của não rõ ràng, nhưng 38-50% bệnh nhân có phù não. Phù não cũng có thể là thay đổi thứ phát của hội chứng này.
Hội chứng não – gan mạn tính có thể thấy ở nhân não, chất xám tiểu não và dưới vỏ não, mô nguyên sinh chất của tế bào hình sao phì đại và tăng lên đồng thời vỏ tế bào mỏng đi, tế bào thần kinh và các sợi thần kinh biến mất, có hoại tử vỏ não sâu, cũng có thể thấy cả ở tiểu não.
2. Lâm sàng
2.1. Hội chứng não – gan cấp tính và mạn tính
Biểu hiện lâm sàng của hội chứng não – gan thường phụ thuộc vào bản chất của bệnh ganban đầu.
Hội chứng não – gan cấp tính thường gặp ở viêm gan tối cấp, hoại tử gan và một tỉ lệ lớn suy gan cấp. Sau một vài ngày khởi phát của bệnh, bệnh nhân đi dần vào tình trạng hôn mê cho đến khi chết, hôn mê có thể không có triệu chứng báo trước.
Hội chứng não – gan mạn tính chủ yếu là do shunt nối cửa – chủ (portosystemic shunt) được tạo thành tự nhiêndo tuần hoàn bàng hệ ở những bệnh nhân bị xơ gan và (hoặc) sau khi phẫu thuật tạo shunt portosystemic. Biểu hiện trạng thái thần kinh từ thờ ơ đến sững sờ, thường tái phát, mạn tính và nếu nặng là tình trạng hôn mê. Hội chứng não – gan cũng thường xảy ra ở người bị xơ gan mà chế độ ăn có nhiều protein, bị chảy máu đường tiêu hóa trên, nhiễm trùng, cổ trướng, sử dụng một số lượng lớn các thuốc lợi tiểu mất kali. Trong giai đoạn cuối của xơ gan, biểu hiện của bệnh não – gan thường khởi đầu từ từ, hôn mê sâu dần và cuối cùng bệnh nhân tử vong.
Quan sát những thay đổi chức năng não, có lợi cho chẩn đoán và điều trị sớm. Đánh giá hiệu quả điều trị dựa trên mức độ thay đổi ý thức, biểu hiện thần kinh và những thay đổi điện não đồ.
2.2. Phân loại giai đoạn củahội chứngnão -gan theo hệ thống phân loại West Haven:
– Giai đoạn 0:
+ Thay đổi tính cách hoặc hành vi.
+ Thay đổi trí nhớ, giảm khả năng tập trung, suy giảm chức năng trí tuệ, và phối hợp.
+ Không có Asterixis (chứng suy tư thế vận động) là bệnh lý biểu hiện bởi sự suy yếu duy trì một tư thế vận động, gây ra bởi sự bất thường chức năng của trung tâm vận động gian não thất phụ trách điều hòa trương lực của các cơ vận động và đối kháng liên quan đến việc duy trì tư thế. Cũng có thể phát hiện asterixis bằng nghiệm pháp viết: Đưa cho bệnh nhân một cây bút và đọc cho bệnh nhân viết, nếu có Astericis thì nét chữ sẽ run.
– Giai đoạn 1:
+ Thiếu nhận thức không đáng kể.
+ Rút ngắn khả năng chú ý.
+ Hypersomnia (là loại rối loạn giấc ngủ rất hiếm gặp. Rối loạn Hypersomnia khiến giấc ngủ có thể kéo dài tới 18 tiếng/ngày và kéo dài từ ngày này sang ngày khác, thậm chí cả tuần). Mất ngủ, đảo ngược của mô hình giấc ngủ.
+ Trầm cảm, khó chịu. Có thể có Asterixis.
– Giai đoạn 2:
+ Thờ ơ hoặc lãnh đạm.
+ Mất phương hướng.
+ Bất lịch sự trong hành vi.
+ Asterixis biểu hiện rõ.
+ Tăng trương lực cơ, dấu hiệu Flapping – Tremor (+).
+ Run gan: để cẳng tay thẳng góc với cánh tay đặt trên mặt giường, thấy bàn tay run, giật nhanh không đều, do rối loạn trương lực cơ nhất là cơ liên đốt.
+ Buồn ngủ, ngủ lịm, thay đổi tính cách rõ ràng, hành vi không phù hợp, và mất phương hướng liên tục, thường là về thời gian.
– Giai đoạn 3:
+ Ngủ gật nhưng có thể tỉnh được khi kích thích.
+ Mất định hướng về thời gian và địa điểm, nhầm lẫn, mất trí nhớ.
+ Thường xuyên giận dữ, không thể hiểu được lời nói.
+ Dấu hiệu Flapping – Tremor (+)
– Giai đoạn 4:
+ Hôn mê có hoặc không có phản ứng với kích thích đau đớn
2.3.Triệu chứng lâm sàng của hội chứng não – gan
Giai đoạn 1: giai đoạn báo trước. Thay đổi nhẹ cá tính và rối loạn hành vi, chẳng hạn như hưng phấn, kích động hoặc sợ hãi, rối loạn hoặc đi tiểu tiện hay đại tiện không tự chủ. Câu trả lời của bệnh nhân vẫn còn chính xác, nhưng phát âm từ không rõ ràng và tương đối chậm, có thể run còn được gọi là run gan hoặc có asterixis,. Bất bình thường điện não đồ (EEG), Giai đoạn này kéo dài vài ngày hoặc vài tuần, triệu chứng đôi khi không rõ ràng, dễ bị bỏ qua.
Giai đoạn 2: tiền hôn mê. Ý thức nhầm lẫn, rối loạn giấc ngủ, rối loạn hành vi. Xuất hiện những triệu chứng mất phương hướng và hiểu biết giảm sút, không xác định đúng thời gian, địa điểm và nhầm lẫn khái niệm. Không thể hoàn thành một phép tính đơn giản, không nhận biết được các hình khối đơn giản như các khối xây dựng, ngôi sao năm cánh, dao động con lắc vv. Nói líu lưỡi, rối loạn viết, hành vi bất thường cũng rất phổ biến. Rối loạn thời gian, ngủ ngày, thậm chí ảo giác, sợ hãi, giận dữ. Bệnh tâm thần được coi là bình thường. Thời gian này ở những bệnh nhân có dấu hiệu thần kinh quan trọng như tăng phản xạ, tăng trương lực cơ, co cứng cơ cẳng chân và dấu hiệu Babinski dương tính. Giai đoạn này thấy bất thường điện não đồ (EEG). Cử động vô thức có thể xảy ra ở một số bệnh nhân và thất điều.
Giai đoạn 3: giai đoạn ngủ. Tinh thần rối loạn, một loạt các dấu hiệu thần kinh kéo dài hoặc tăng trong hầu hết thời gian, bệnh nhân bị hôn mê, nhưng có thể được đánh thức còn gọi tình trạng này là ngủ gà. Trong thời gian thức có thể trả lời câu hỏi, nhưng thường nhầm lẫn và ảo giác. Run vẫn là triệu chứng thường thấy. Tăng trương lực cơ, chân tay bắt chuồn chuồn. Thường có bất thường dạng sóng điện não đồ.
Giai đoạn 4: hôn mê. Mất hoàn toàn ý thức, không thể thức dậy khi kích thích. Khó chịu với tư thế kích thích đau và phản ứng, phản xạ gân và cơ tăng. Hôn mê sâu, các phản xạ thay đổi khác nhau, giảm trương lực cơ, có thể có co giật kịch phát, rung giật mắt và tăng thông khí. EEG bất bình thường.
Ranh giới của mỗi giai đoạn thườngkhông rõ ràng, biểu hiện lâm sàng các giai đoạn có thể chồng lên nhau. Tiến triển của bệnh có thể cải thiện sau khi điều trị, mức độ cải thiện có thể lùi giai đoạn hoặc thoát hôn mê. Số ít bệnh nhân với hội chứng não – gan mãn tính trong các giai đoạn khác nhau đã có tổn hại hệ thống thần kinh trung ương xảy ra với sự suy giảm tinh thần, mất điều hòa, những biểu hiện tạm thời có thể tồn tại và nó sẽ trở thành vĩnh viễn.
Lâm sàng của giai đoạn tiềm ẩn bệnh não – gan: bệnh nhân không có biểu hiện lâm sàng, tham gia vào các hoạt động xã hội bình thường. Trong khi lái xe, có nguy cơ tai nạn giao thông, do đó rất được các nước phương tây coi trọng trong những năm gần đây, về phân loại giai đoạn lâm sàng của bệnh não gan là giai đoạn 0.
Tổn thương gan nghiêm trọng thường vàng da rõ ràng, bệnh não – gan, chảy máu tiêu hóa và hơi thở có mùi gan. Bệnh sẽ diễn biến phức tạp bởi một loạt các biến chứng nhiễm trùng, hội chứng gan thận và phù não vv, biểu hiện lâm sàng phức tạp hơn.
2.3. Cận lâm sàng
– Xét nghiệm nồng độ amoniac máu:
Bình thường nồng amoniac huyết thanh máu tĩnh mạch lúc đói là 40 ~ 70μg/dl. Amoniac huyết thanh máu tĩnh mạch lúc đói tương đối ổn định và đáng tin cậy. Hội chứng não – gan đặc biệt là portosystemic shunt có nồng độ amoniac trong máu cao. Trong suy gan cấp tính do bệnh não, amoniac bình thường.
– Điện não đồ (EEG):
EEG không phải là chỉ định có giá trị chẩn đoán, ở một mức độ nhất định có ý nghĩa tiên lượng. Thay đổi nhịp điệu sóng chậm điển hình, chủ yếu là 4-7 lần mỗi phổ của sóng θ, một số cũng xảy ra 1-3 lần mỗi sóng δ. Tình trạng hôn mê xảy ra khi thấy đồng thời trên cả hai mặt biến động cao đối xứng của sóng δ.
– Test kiểm tra trí thông minh đơn giản:
Sử dụng các test kiểm tra trí thông minh sẽ giúp cho chẩn đoán sớm bệnh não – gan hữu ích nhất. Test bao gồm văn bản, bản vẽ, xây dựng khối, xếp có ngôi sao năm cánh với các que diêm, vv.
– Chẩn đoán hình ảnh:
Bệnh nhân bị bệnh gan cấp tính, hình ảnh CTscan sọ não và MRI sọ não thấy phù não. Bệnh nhân bị bệnh gan mạn tính có thể thấy mức độ khác nhau của teo não. Ngoài ra, chụp cộng hưởng từ sọ não ở bệnh nhân xơ gan được hiển thị T1W trong globus pallidus thấy tăng tín hiệu nhiễm độc mangan tính.
Hình 2: Các tế bào não được gọi là tế bào hình sao từ một bệnh nhân nghiện rượu 51 tuổi bị xơ gan đã tử vong khi hôn mê (hội chứngnão – gan). Hình ảnh cho thấy cả hai loại tế bào hình sao bình thường (N), trong đó có hạt nhân tối, và tế bào hình sao Alzheimer loại II (Alz), đặc trưng củahội chứngnão – gan, có màu nhạt, hạt nhân mở rộng.
Hình 3: Hình ảnh cộng hưởng từ (MRI) của một bệnh nhân xơ gan trong cùng độ tuổi (P). Ở bệnh nhân nghiện rượu, tín hiệu bất thường cường độ cao (mũi tên) được phát hiện trên cả hai phía của não bộ trong khu vực được gọi là cầu nhạt.
3. Chẩn đoán và chẩn đoán phân biệt
3.1. Chẩn đoán
Chẩn đoán bệnh não gan dựa vào:
– Bệnh nhân có bệnh gan nặng và (hoặc) được làm shunt nối thông cửa – chủ.
– Rối loạn tâm thần, buồn ngủ hoặc hôn mê.
– Có các yếu tố nguy cơ: suy thận, nhiễm trùng, xuất huyết tiêu hóa, táo bón, dùng các thuốc (ma tuý, thuốc an thần) có ảnh hưởng đến hệ thống thần kinh trung ương, thuốc lợi tiểu, và tình trạng quá tải protein do chế độ ăn uống. Những yếu tố này làm tăng sản xuất các chất độc hại đối với não.
– Tăng amoniac máu.
– Run.
– Điện não đồ thay đổi điển hình có giá trị tham khảo quan trọng.
– Test kiểm tra trí thông minh thấy bất thường có thể cho phép chẩn đoánhội chứngnão – gan dưới lâm sàng (hội chứng não – gan tiềm tàng).
3.2. Chẩn đoán phân biệt
– Các triệu chứng tâm thần là biểu hiện nổi bật củahội chứngnão -gan, cần chẩn đoán phân biệt với bệnh rối loạn tâm thần,
– Hôn mê gan cũng có thể nhầm lẫn với hôn mê do các bệnh khác như tiểu đường, hạ đường huyết, nhiễm độc ure máu, tai biến mạch máu não, nhiễm trùng não và quá liều thuốc an thần.
Để chẩn đoán phân biệt cần hỏi kỹ tiền sử bệnh gan và kiểm tra kích thước lách, chức năng gan, amoniac máu, làm điện não đồ và các xét nghiệm khác sẽ giúp chẩn đoán bệnh và chẩn đoán phân biệt.
4. Điều trị
Hội chứng não gan hiện nay chưa có liệu pháp điều trịđặc hiệunên cần điều trị toàn diện:
4.1. Loại bỏ các yếu tố nguy cơ
Một số yếu tố có thể gây ra hoặc làm nặng thêm hội chứng não – gan. Ở bệnh nhân xơ gan, các thuốc tăng thời gian bán hủy trong cơ thể, gây độc cho não do não ở bệnh nhân tăng nhạy cảm, phần lớn không thể chịu đựng được gây mê, giảm đau, thôi miên, thuốc an thần và các loại thuốc khác, chẳng hạn như sử dụng không đúng, có thể gây hôn mê. Khi bệnh nhân có cơn co giật kích động, khi sử dụng morphin và các dẫn xuất paraldehyde của nó, chloral hydrate, meperidine, thuốc an thân cần giảm liều (1/2 hoặc 1/3) và giảm số lần dùng trong ngày. Đôi khi cần sử dụng các thuốc kháng histamin như chlorpheniramine để thay thế cho thuốc chống loạn thần. Phải kiểm soát kịp thời các nhiễm trùng và chảy máu đường tiêu hóa trên, tránh sử dụngkéo dài liều caothuốc lợi tiểu mất kali và chọc tháo dịch cổ trướng nhanh. Lưu ý rằng điều chỉnh nước, điện giải và cân bằng acid-base là quan trong.
4.2. Giảm hấp thu các chất độc từ đường ruột
– Chế độ ăn giảm protein bắt đầu trong vòng vài ngày. Cung cấp hàng ngày lượng calo 1.200-1.600 calo và đủ vitamin, đủ carbohydrate. Nếu bệnh nhân hôn mê cần cho ăn qua ống thông qua mũi vào dạ dày. Chất béo có thể làm chậm tiêu ở dạ dày nên sử dụng ít hơn. Cho dung dịch chất lỏng với 25% sucrose hoặc glucose, năng lượng 1 kcal mỗi ml, 3 ~ 6g các axit amin thiết yếu hàng ngày. Để làm sạch dạ dày nên dừng cho ăn, nuôi dưỡng được thay bằng truyền tĩnh mạch sâu dung dịch glucose 25% để duy trì dinh dưỡng. Khi truyền lượng lớn glucose trong giai này, phải thận trọng hạ kali máu, suy tim và phù não. Khi thức tỉnh trở lại có thể tăng dần lượng protein đến 40 ~ 60g/ngày. Nguồn gốc khác nhau của protein có xu hướng gây ra hôn mê khác nhau, protein là thịt có tỉ lệ gây ra bệnh não lớn nhất, tiếp theo là protein sữa, thấp nhất protein thực vật. Vì vậy, để sửa chữa cân bằng nitơ âm tính của bệnh nhân nên sử dụng protein thực vật là tốt nhất. Protein thực vật có chứaítmethionine, axit amin thơm, axit amin chuỗi nhánh hơn protein động vật, và có thể làm tăng bài tiết nitơ qua phân. Ngoài ra, các thuốc nhuận tràng có tác dụng có lợi, có thể áp dụng cho những bệnh nhân bị bệnh não gan.
– Thuốc xổ hay thuốc tẩyđểloại bỏ chậm lưu thông đường ruột, loại bỏ máu hoặc các chất đạm khác, có thể pha dung dịch với nước muối hoặc axit (ví dụ như pha loãng dung dịch axit axetic). Thuốc xổ, hoặc uống bằng miệng hoặc bơm vào ống thông qua mũi magnesium sulfate 25% từ 30 ~ 60ml. Ở bệnh nhân có Shunt Portosystemic bị bệnh não cấp tính cho lactulose 500ml thụt là biện pháp điều trị đầu tiên được khuyến cáo.
– Ức chế vi khuẩn phát triển trong đường ruột: neomycin uống 2 ~ 4g/ngày hoặc chọn paromomycin, kanamycin, ampicillin cũng có hiệu quả tốt. Uống metronidazol 0,2 g, 4 lần một ngày hiệu quả bằng neomycin nhưng ít gây rối loạn chức năng thận.
– Lactulose (lactulose, β-galactosidofructose) sau khi uống, trong đại tràng vi khuẩn tạo ra axit lactic và axit axetic làm ruột có tính axit, do đó làm giảm sự hình thành và hấp thụ amoniac. Ngừng neomycin ở bệnh nhân cần điều trị lâu dài với lactulose hoặc thuốc sorbitol. Xi-rô lactulose và bột, liều hàng ngày 30 ~ 100ml hoặc 30 ~ 100g chia ba lần, liều lượng nhỏ, để điều chỉnh 2-3 lần đi vệ sinh hàng ngày, phân có pH = 5 ~ 6 là phù hợp. Tác dụng phụ gây đau bụng, buồn nôn và nôn. Sữa sorbitol (1actitol, β-galactosido-sorbitol) là lactulose tương tự và disaccharide có thể được làm thành dạng viên hoặc xi-rô, dễ bảo quản, sự trao đổi chất và hiệu quả của lactulose và liều lượng hàng ngày cũng 30g, uống ba lần. Trong những năm gần đây, người ta phát hiện ra rằng do thiếu lactase trong ruột kết của số đông người, nên chất latose lên men do vi khuẩn cũng làm giảm độ pH phân, giảm hàm lượng amoniac, để điều trị bệnh não gan, ảnh hưởng lactulose và lactose giống nhau, nhưng lactose cógiá rẻ hơn. Bệnh não cấp tính do portosystemic shunt, hiệu lực của lactulose khá. Liều hai lần mỗi ngày, mỗi lần 5g đường uống.
4.3. Thúc đẩy sự chuyển hóa các chất độc hại, sửa chữa các rối loạn chuyển hóa acid amin
Sử dụng các thuốc làm giảm amoniac:
– Glutamat kali (mỗi 6.3g/20ml, 34mmol kali) hoặc glutamat natri (mỗi 5.75g/20ml, natri 34mmol) pha trong dung dịch glucose truyền tĩnh mạch 1 hoặc 2 lần/ngày. Sử dụng glutamate kali hay natri, tùy thuộc vào nồng độ kali, nồng độ natri trong huyết thanh và tình trạng bệnh, thiểu niệu cần hạn chế đưa kali vào, cổ trướng cần giảm natri.
– Arginine 10 ~ 20g pha vào glucose truyền tĩnh mạch mỗi ngày một lần, thuốc này gây kích thích tổng hợp urê, thuốc có tính axit nên cho bệnh nhân có độ pH trong máu cao. Thuốc hạ amoniac tác dụng tốt trên bệnh nhân có portosystemic shunt, tốt hơn trên bệnh nhân có hội chứng não – gan mạn tính, viêm gan gây hôn mê gan cấp nặng không nên dùng.
– Natri benzoat đường uống có tác dụng kết hợp với các nitơ còn lại như glycine hoặc glutamine để tạo thành axit hippuric thải trừ qua thận, do đó làm giảm amoniac máu.
– Axit glutamine uống kết hợp để tạo thành axit hippuric không độc hại thải trừ qua thận, nhưng cũng có thể làm giảm nồng độ amoniac.
– Ornithine-α-ketoglutarate và ornithine aspartate làm giảm đáng kể vai trò của amoniac.
4.4. Điều chỉnh tỉ lệ amino acid chuỗi nhánh
Sử dụng BCAA (Branched-Chain Amino Acids) đường uống hoặc tiêm tĩnh mạch để điều chỉnh tỉ lệ amino acid chuỗi nhánh. BCAA bao gồm 3 loại amino acid: leucine, isoleucine, and valine. Tên gọi của BCAA được bắt nguồn từ cấu trúc của các hợp chất này: leucine, isoleucine và valine là các acid amin chuỗi nhánh, vì vậy được đặt tên là chuỗi acid amino phân nhánh (BCAA). Về mặt lý thuyết, có thể điều chỉnh sự mất cân bằng trong quá trình chuyển hóa acid amin gây ức chế dẫn truyền thần kinh sai trong não, nhưng tác dụng với những bệnh nhân có shunt cửa – chủ vẫn còn tranh cãi. Axit amin chuỗi nhánh thấp hơn mức trung bình có vai trò gây ra hôn mê. BCAA được lựa chọn cho ở những bệnh nhân cần hạn chế thực phẩm protein, lượng vừa đủ giàu nhánh chuỗi amino axit hỗn hợp trên có tác dụng phục hồi chức năng não ở bệnh nhân mất cân bằng nitơ tỏ ra có hiệu quả và an toàn.
4.5. Sử dụng hợp chất đối kháng thụ thể GABA/BZ
– Bicuculline là chất đối kháng thụ thể GABA.
– Flumazenil là thuốc an thần đối kháng thụ thể BZ.
Ứng dụng Flumazenil với liều lượng lớn hơn truyền tĩnh mạch (Flumazenil 15mg truyền tĩnh mạch 3 giờ trở lên) đã được báo cáo, 45% thất bại đối với viêm gan tối cấp gây bệnh não, và 78% thành công trong cải thiện các triệu chứng ở bệnh nhân xơ gan và hôn mê cho thấy tiềm năng tốt, nhưng các triệu chứng tái phát sau ngưng truyền một vài giờ. Một nghiên cứu khác đã báo cáo rằng liều tiêm tĩnh mạch của Flumazenil 0,2mg thấy điện não đồ không có cải thiện sau 3 phút, liều lượng tăng lên đến 0,4mg, sau đó 0,8mg, 1 ~ 2mg, đến một trường hợp tổng liều 9.6mg, 14 bệnh nhân có cải thiện chiếm 71%. Một nghiên cứu khác với một liều 10ml 0,5 mg pha với nước muối 0,9% tiêm tĩnh mạch trong vòng 5 phút, sau đó truyền thêm 250ml nước muối 0,9% trong 30 phút ở bệnh nhân xơ gan có các triệu chứng củahội chứngnão – gan thấy triệu chứng cải thiện tốt.
4.6. Ghép gan
Cho đến nay ghép gan vẫnlà biện pháp hoàn hảo nhất trong điều trị xơ gan và hội chứng não-gan, tuy nhiên thiếu nguồn tạng hiến là trở ngại chính đối với phương pháp này.
5. Phòng ngừa
– Chủ động phòng ngừa bệnh gan.
– Bệnh nhân đã bị bệnh gan nên tránh tất cả các yếu tố nguy cơ gây ra bệnh não gan.
– Cần theo dõi sát bệnh nhân bị bệnh gan để phát hiện hội chứng não – gan và hôn mê gan ngay đầu giai đoạn tiền triệu và điều trị thích hợp vì phát hiện và điều trị sớm thường mang lại kết quả tốt.
6. Tiên lượng
Nếu phát hiện sớm và loại bỏ được các yếu tố nguy cơ như chảy máu đường tiêu hóa cao, giảm kali máu vv, thì tiên lượng tốt hơn.
Nếu chức năng gan còn tốt, nên thực hiện phẫu thuật tạo shunt cửa chủ, bởi vì ăn protein cao gây ra hội chứng não – gan do portosystemic shunt thì tiên lượng tốt hơn.
Báng bụng, vàng da, xu hướng chảy máu, suy giảm nặng chức năng gan nặng thì có tiên lượng xấu. Suy gan tối cấp gây ra bệnh não gan có tiên lượng xấu.


